Pelarut pelarut ini tidak reaktif dan inert secara kimia. Berdasarkan sifat pelarut air tersebut maka kita dapat mengetahui kepolaran suatu senyawa dengan menguji kelarutannya dalam air.
Ikatan Polar Molekul Anorganik Wikipedia Bahasa Indonesia
Contoh pelarut non polar. Pelarut non polar mengandung ikatan dengan atom elektronegatif yang sama seperti c dan h. Senyawa polar dan non polar pengertian ciri kovalen perbedaan sifat titik didih contoh. Cl2 pcl5 h2 n2. Karena kemampuannya untuk melarutkan kedua senyawa polar dan nonpolar aseton dianggap oleh banyak orang sebagai pelarut yang sangat baik sebagian besar pelarut lain hanya dapat melarutkan senyawa polar atau non polar. Selain itu aseton adalah pelarut yang kuat karena merupakan bahan yang mudah larut. Lemak dan minyak larut dalam pelarut non polar.
Contoh contoh pelarut non polar termasuk benzena ccl4. Oleh karena itu air akan melarutkan senyawa senyawa yang bersifat polar dan sebaliknya tidak melarutkan senyawa nonpolar. Pelarut organik adalah bahan kimia organik mengandung atom karbon yang umum digunakan untuk melarutan benda padat cair atau gas. Namun ada banyak variasi dalam pelarut non polar dimana ada beberapa pelarut lebih polar daripada yang lain. Contoh pelarut non polar yaitu. Air merupakan pelarut universal yang bersifat polar.
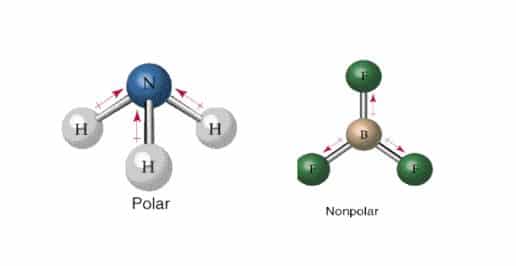
Contoh pelarut organik adalah sebagai berikut. Sebuah dipol bentuk dengan bagian dari molekul membawa muatan positif sedikit dan bagian lain yang membawa muatan negatif sedikit. Hal ini terjadi ketika ada perbedaan antara elektronegativitas dari setiap atom. Contoh kovalen nonpolar contoh kovalen polar contoh pelarut non polar contoh senyawa kovalen non polar contoh soal elektrolit gambar senyawa polar ikatan kimia ikatan kovalen kovalen nacl polar atau nonpolar perbedaan kovalen polar dan non polar polar dan nonpolar senyawa kovalen. Dalam hal ini untuk dapat membedakan kedua senyawa berikut ini yakni senyawa polar dan non polar yang dapat ditunjukan dari beberapa sisi yang diantaranya dari ciri senyawa distribusi elektronnya dan ukuran kuantitatif titik didih. Larutan yang dihasilkan merupakan konduktor listrik yang baik.
Kloroform adalah contoh lain pelarut non polar yang biasanya digunakanpelarut polar bagus untuk melarutkan senyawa polar dan ionik tapi tidak bagus untuk zat non polar sementara sebaliknya baik untuk pelarut non polar. Molekul polar terjadi ketika dua atom tidak berbagi elektron sama di ikatan kovalen. Pelarut protik dan aprotik. Biasanya pelarut anorganik merupakan pelarut yang bersifat polar sehingga tidak larut dalam pelarut organik dan non polar. Contoh dari pelarut anorganik adalah amonia dan asam sulfat. Ini terdiri dari molekul non polar dan dapat melarutkan senyawa atau zat terlarut non polar.
Oleh karena itu untuk menghilangkan lemak dari ekstrak petroleum eter digunakan dalam industri. Perbedaan ekstrim membentuk ikatan ion sedangkan perbedaan yang lebih rendah membentuk ikatan. Pelarut organik dapat bersifat polar maupun non polar bergantung pada gugus kepolaran yang dimilikinya.